Con 15 años de mora, la Dirección de Farmacia y Drogas del Ministerio de Salud (Minsa) comenzará a trabajar en la reglamentación del artículo 26 de la Ley de Medicamentos (Ley No. 1 del 10 de enero de 2001).
Para las asociaciones de pacientes y médicos especialistas, la reglamentación de este artículo es importante porque garantiza que solo entrarán al país medicamentos seguros y eficaces.
Dicho artículo establece: “Se considerará de básica presentación la evidencia de equivalencia terapéutica cuando se trate de medicamentos para enfermedades críticas o graves y de aquellos que, por la naturaleza de su uso, sean considerados por la Comisión Técnica Consultiva. Para la aplicación de este requisito, la Comisión emitirá previamente la lista de productos que estarán ubicados bajo esta disposición”.
El primer paso que deben seguir las autoridades sanitarias para reglamentar este artículo es clasificar las patologías que estarán bajo la denominación de enfermedades críticas y agudas.
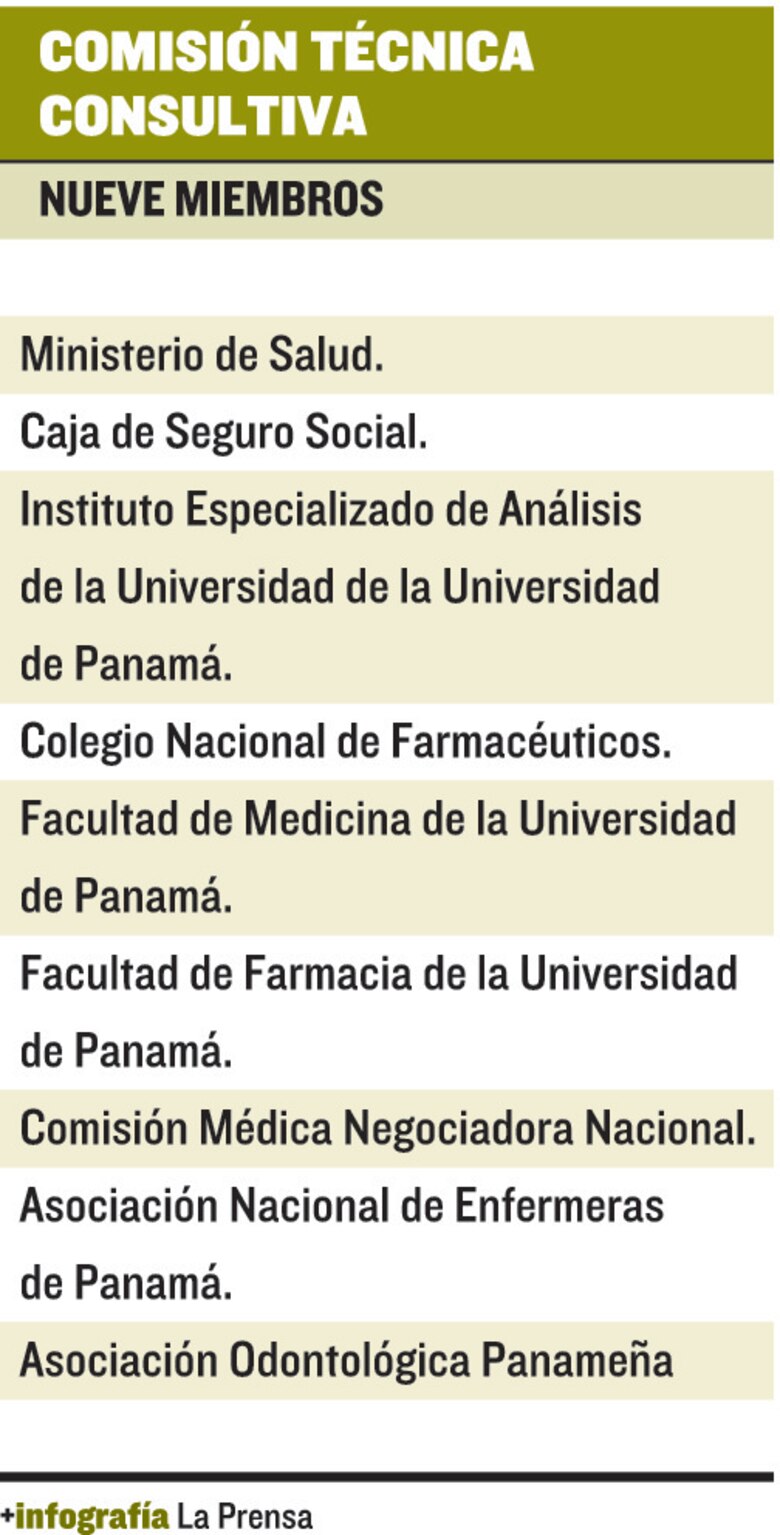
En ese sentido, Jenny Vergara, directora de Farmacia y Drogas del Minsa, explicó que, debido a la falta de reglamentación y a la solicitud de las asociaciones de pacientes, convocaron a la Comisión Técnica Consultiva, creada por la Ley No. 1 de 2001 y conformada por 9 miembros, a trabajar en el tema. (Ver tabla).
Vergara indicó que, como harán una clasificación de las patologías críticas y agudas invitarán a especialistas, ya que los tratamientos para estas enfermedades deberán contar con un certificado de intercambiabilidad o bioequivalencia. Añadió que pidieron a la Organización Panamericana de la Salud colaborar en la capacitación de los miembros de la Comisión y los médicos especialistas.
PARTICIPACIÓN
La vicepresidenta de la Fundación de Artritis Reumatoidea de Panamá, Enma Pinzón, informó que la Federación Nacional de Pacientes con Enfermedades Críticas, Crónicas y Degenerativas remitió una carta al ministro de Salud, Francisco Javier Terrientes, con copia al procurador general de la Administración, Rigoberto González, para pedir, en aras de la transparencia y el consenso, participar como oyentes en las reuniones.
Agregó que luego de 15 años de mora, lo único que pueden esperar es que la reglamentación esté acorde con las normas que en esta materia tienen los países de primer mundo.
Esta federación ha pedido, por ejemplo, que la Caja de Seguro Social (CSS) suspenda la licitación de compra de fármacos por $72.7 millones alegando que se requieren estudios de efectividad de los fármacos.
Pero, mediante resolución No. 1655 del 14 de diciembre de 2015, el Minsa prohibió a las entidades públicas solicitar requisitos extraordinarios para adquirir fármacos. La Autoridad de Protección al Consumidor y Defensa de la Competencia ha alegado que fijar requisitos distintos a los de la Ley 1 para la compra de fármacos reduce la posibilidad de participar a nuevas empresas y posibles competidores.
ESPECIALISTA
El presidente de la Sociedad Panameña de Hematología, Fernando Díaz, explicó que la reglamentación de este artículo de la ley es un paso importante para en un futuro “sanar las falencias” que existen en la Ley de Medicamentos.
Díaz indicó que la clasificación de las enfermedades obligaría a que los medicamentos genéricos para entrar al país demuestren su equivalencia terapéutica con el producto de referencia.
Añadió que en estos momentos, como el artículo no está reglamentado, no se solicita este requisito, lo que permite la potencial entrada de fármacos genéricos con seguridad y eficacia dudosa.
Al hablar de la participación de los especialistas en estas reuniones, indicó que sustentarán, desde su punto de vista técnico, cuáles enfermedades cumplen con los requisitos para ser consideradas como críticas o graves.
Expresó que la reglamentación es bien vista, porque resolverá el principal escollo que existe para asegurar que únicamente medicamentos seguros y eficaces entren al país. Opinó, sin embargo, que es una medida tardía, porque mientras se realiza el proceso, se continúa otorgando registros sanitarios a diestra y siniestra, sin cumplir con el artículo 26.
Agregó que por eso recomendaron que mientras se solucione esta situación, se le quite transitoriamente los Registros Sanitarios a los genéricos que no estén aprobados para su comercialización por las Agencia de Drogas y Medicamentos de Estados Unidos, Europa o Japón.
