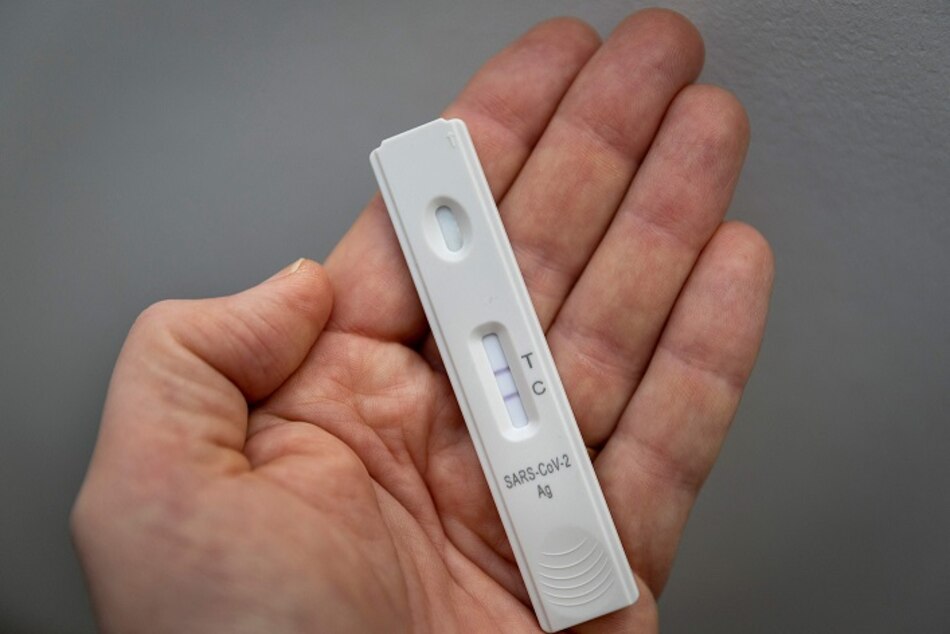
La resolución No. 037 que establece los requisitos para obtener el registro sanitario de las pruebas autoaplicadas para la detección de la Covid-19 fueron publicados en Gaceta Oficial.
Estos requisitos deben ser cumplidos por todas las instituciones públicas, establecimientos privados o persona natural que comercialice o importe las pruebas autoaplicadas.
Con el fin de atender la demanda de pruebas, el Ministerio de Salud (Minsa) autorizó el uso de pruebas autoaplicadas avaladas por el Instituto Conmemorativo Gorgas (Icges).
La Resolución No.037 “exceptúa la evaluación diagnóstica, a las pruebas auto aplicadas para la detección del antígeno de la proteína de nucleocápside del Sars-CoV-2 (Covid-19), en muestras de hisopado nasal, dentro del trámite para la obtención del registro sanitario, para uso de la población en todo el territorio nacional, como medida extraordinaria de salud pública y dicta otras disposiciones”.
La resolución No.037 señala que los resultados de las pruebas autoaplicadas para la detección del antígeno de la proteína de nucleocápside del Sars-CoV-2, en muestras de hisopado nasal, “son de carácter orientativo, sin valor diagnóstico, a excepción de lo que disponga la autoridad de salud”.
Los requisitos que se deberán cumplir para obtener el registro sanitario son los siguientes:
1. Poder y memorial, debidamente notariado y firmado por el representante legal de la empresa distribuidora en Panamá y el abogado. Se aceptará un producto por expediente.
2. Licencia de Operación vigente emitida por la Dirección Nacional de Dispositivos Médicos del Ministerio de Salud.
3. Declaración Jurada para el registro sanitario de las pruebas autoaplicadas para la detección de la Covid-19.
4. Copia de Aviso de Operaciones, que incluya la actividad descrita en la Licencia de operación.
5. Certificado de Registro Público.
6. Carta de autorización del fabricante, notariada y apostillada (original y copia, acompañada de su traducción al español, si es el caso).
7. Certificado de Libre Venta, notariada y apostillada del país de procedencia (original y copia, acompañada de su traducción al español, si es el caso) y en el caso de los productos procedentes de regiones distintas a Estados Unidos, deberá aportar el certificado de Libre Venta, que incluya el marcado CE o la certificación de este último. De no contar con el Certificado de Libre Venta, podrá hacer entrega de la autorización de uso de emergencia de la FDA que identifique el dispositivo a registrar, debidamente legalizado y traducido por un traductor público autorizado.
8. Certificado de Buenas Prácticas de Manufactura, expedido por la autoridad competente del país de origen (fabricante real), o en su defecto, certificación ISO 13485:16, notariado y apostillado (original y copia, acompañada de su traducción al español, si es el caso).
9. Aportar él historial de comercialización de la prueba a registrar.
10. Formulario No. 1, debidamente completado y firmado por el representante legal de la empresa o al que éste designe (no se aceptarán formularios firmados por otras personas que se encuentren descritas en el poder que antecede).
11. Aportar inserto de la prueba a registrar en idioma español, el cual deberá contener la sensibilidad y especificidad del producto, en un valor igual o mayor al 90%.
12. Aportar la etiqueta del empaque, tal como se comercializará en el país, la cual deberá contener, como mínimo, la información del nombre comercial, catálogo, marca, fabricante, país, distribuidor y registro sanitario.
Agrega que el “registro sanitario estará vigente hasta que la autoridad de salud considere que debe permanecer esta medida extraordinaria de salud pública”.
La Dirección Nacional de Dispositivos Médicos del Minsa estará a cargo de la vigilancia de las pruebas autoaplicadas para la detección de la Covid-19, en conjunto con el Laboratorio Central de Referencia de Salud Pública del Icges y el Departamento Nacional de Evaluación y Gestión de Tecnología Sanitaria de la Caja de Seguro Social y se efectuará con base a las especificaciones o características del producto declaradas por el fabricante.